|
|
QUÍMICA
Los Procesos de la Ciencia

Grado 10
MÓDULO 1
El Sistema métrico y el SI
El sistema métrico fue creado por científicos franceses en 1795. Hasta entonces, la comunicación entre los científicos había sido difícil debido a que las unidades de medición no estaban estandarizadas. El sistema métrico brinda un conjunto de estándares de medición que es conveniente utilizar, ya que las unidades de diferentes tamaños están relacionadas por potencias de 10.
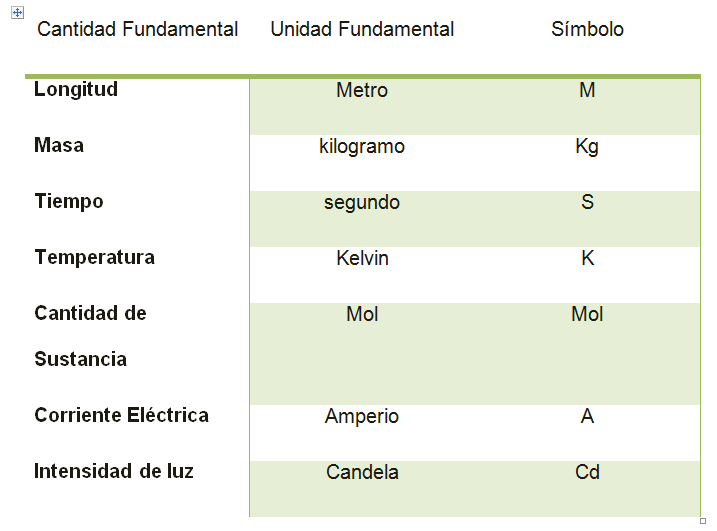
La unidad fundamental de longitud del SI, es el metro, m. El metro se definió por primera vez como 1/10,000,000 de la distancia desde el polo norte hasta el Ecuador, medido a lo largo de una línea que pasa por Lyon, Francia.
Los métodos para comparar el tiempo se han vuelto mucho más precisos que los de comparar longitudes. En 1983, el metro se definió como la distancia recorrida por la luz en el vacío durante un intervalo de tiempo de 1/299,792,458 s. La unidad estándar de tiempodel SI es el segundo, s. Inicialmente, el segundo se definió como 1/86,400 del día solar medio, el cual es la duración media del día durante un periodo de un año, aproximadamente 24 horas. Se sabe que la rotación de la Tierra está volviéndose lenta y los días se están haciendo largos, por lo que el estándar no es constante. En la década de 1960, se desarrollaron relojes atómicos que ganan o pierden sólo 1 s en aproximadamente 3,000,000 de años. Comúnmente, se define el segundo en términos de la frecuencia de un tipo de radiación emitida por un átomo de cesio-133.
La tercera unidad patrón, es el kilogramo, kg, que mide la masa de un objeto. El kilogramo es la masa de un pequeño cilindro metálico que permanece en condiciones muy controladas de temperatura y humedad
Unidades derivadas
Una amplia variedad de unidades, llamadas unidades derivadas son combinaciones de las unidades fundamentales. Una unidad derivada muy común es el metro por segundo, m/s, usada para medir la velocidad, y otra el joule, kg.m2/s2, usado para medir la energía. A medida que aprendas las unidades fundamentales y derivadas, hallarás que es útil al resolver problemas de física considerar las unidades de cada término de la ecuación como cantidades algebraicas, para ayudar a asegurar la exactitud de una respuesta.
Prefijos del SI
El sistema métrico es decimal. Los prefijos se utilizan para cambiar las unidades del SI, en potencias de 10. Para utilizar de manera efectiva las unidades del SI, debes saber el significado de los prefijos indicados en la tabla que se presenta a continuación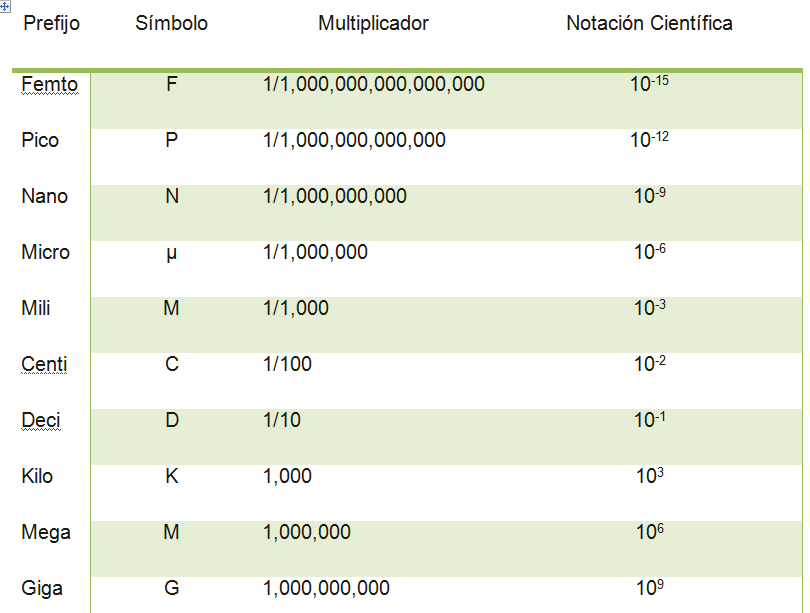
Notación científica
Muchos de los valores numéricos de los multiplicadores de la tabla anterior son dígitos muy grandes muy pequeños. Escritos de este modo, los valores de las cantidades ocupan mucho espacio. Estas medidas tan grandes o tan pequeñas son difíciles de leer, sus tamaños relativos son difíciles de determinar y es complicado su uso en los cálculos. Para trabajar más fácilmente con dichos números, estos se escriben en notación científica expresando los decimales como potencias de 10. La parte numérica de una cantidad se escribe como un número entre 1 y 10 multiplicado por una potencia entera de 10.
M x 10n
1 ≤ M ≥ 10 y n es un número entero. Para escribir la notación científica al escribir los números, mueve el punto decimal hasta que a la izquierda de él sólo quede un número distinto de cero. Luego cuenta el número de lugares que desplazaste el punto decimal, y emplea ese número como exponente de 10. La distancia media de Marte al Sol es 227,800,000,000 m. En la notación científica, esta distancia sería 2.278 x 1011 m. El número de lugares que mueves el decimal a la izquierda se expresa como un exponente positivo de 10.
La masa de un electrón es aproximadamente 0.000 000 000 000 000 000 000 000 000 000 911 kg. Para escribir este número en notación científica, el punto decimal se mueve 31 lugares hacia la derecha. Como resultado, la masa del electrón se escribe como 9.11 x 10-31 kg. El número de lugares que desplazas el decimal hacia la derecha se expresa como exponente negativo de 10. También puedes hacerlo al revés para expresar una notación científica en forma desarrollada.
Conversión de unidades
En ocasiones, es necesario hacer un cambio de unidades para resolver ciertos problemas en física. A esto se le llama conversión de unidades. Esta conversión puede ser de una unidad del SI a otra o entre unidades de distintos sistemas de medidas. A continuación una explicación de cómo resolver un problema de conversión de unidades:
¿Cuál es el equivalente en kg de 465 g? A partir de lo indicado en la tabla de la página anterior donde conociste el valor por los prefijos de las unidades sabes que en un 1 kg = 1000 g. Entonces (1000g)/(1 kg) = 1. ¿Cómo puede usarse esta información para convertir unidades?
El método de factor de conversión para cambio de unidades
Una manera fácil de convertir una cantidad expresada en una unidad a dicha cantidad expresada en otra unidad consiste en usar un factor de conversión, una relación entre las dos unidades. Un factor de conversión es un multiplicador igual a 1. Como 1 kg = 1000 g, puedes elaborar los siguientes factores de conversión:
1 = 1 kg / 1000 g ó 1 = 1000 g / 1 kg
Recuerda que el valor de una cantidad no cambia cuando se multiplica o se divide entre 1. Por tanto, para hallar el equivalente en kg de 465g, multiplica esto por un factor de conversión adecuado
465 g = (465 g) (1 kg / 1000 g) = 465 g x 1 kg / 1000 g = 0.465 kg
Las clasificaciones de unidades se cancelan como las cantidades algebraicas. Si las unidades finales no tienen sentido, revisa tus factores de conversión. Puede haberse invertido un factor, o haberse escrito incorrectamente. Este método de convertir una unidad en otra se llama método del factor de conversión para cambio de unidades.
TRABAJO 1 – Unidades del SI. Valor 32 puntos
I - Completa el siguiente organizador gráfico de tela de araña con las unidades del Sistema Internacional y la cantidad que miden. Ejemplo: Si la pulgada es una unidad del SI, la cantidad sería longitud. 28 puntos 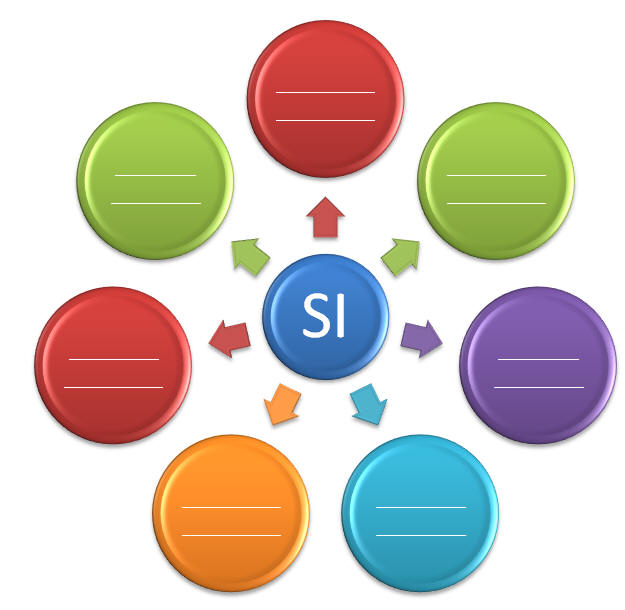
II – Contesta lo siguiente: ¿Cuál es la utilidad de un sistema de medidas como el Sistema Internacional? Valor. 4 puntos
TRABAJO 2 - Práctica notación científica. Valor 24 puntos
Expresa las siguientes cantidades en forma desarrollada.
1. 5.4 x 102m
2. 3.5 x 105 m
3. 3.021 x 109 m
4. 8.6 x 1010 m
5. 1.508 x 10-4 kg
6. 4.5 x 10-7 kg
7. 3.600 x 10-4 kg
8. 4 x 10-3 kg
9. 3.0 x 105 s
10. 1.86 x 105 s
11. 5.0 x 10-5 s
12. 1.3 x 105 s
TRABAJO 3 - Práctica de conversión de unidades. Valor 24 puntos
I - Convierte cada una de las siguientes medidas de longitud como se indica:
A. 6.1 cm a metros
B. 88.2 m a milímetros
C. 25.1 km a micrómetros
D. 2.278 x 1011 m a kilómetros
II - Convierte cada una de las siguientes medidas de masa a su equivalente en kilogramos:
A. 1447 g
B. 113 Mg
C. 9.23 µg
D. 500 mg
Información conceptual:
TEMA: MÉTODO Y DESTREZAS DE LA QUÍMICA

En la química, al igual que en otras ramas de las ciencias naturales, se utiliza el método científico, tanto para la solución de problemas simples, como para investigaciones más complejas. Para poder entender la metodología que se usa en la química, es necesario que repasemos el método científico.
El método científico
El método científico consiste en una serie de pasos para resolver un problema. Es un proceso cíclico, que a menudo, entrelaza los pasos. Por lo que no se puede establecer un orden específico. Sin embargo, por lo general, el primer paso es la observación. La observación en las ciencias se hace con todos los sentidos. Por ejemplo, en química se puede observar el color, la temperatura al tacto y el olor que emite una vela encendida.
Luego que observamos, es que podemos darnos cuenta de que existe un problema o situación para investigar. Isaac Newton, tal vez nunca hubiese tenido curiosidad por investigar el por qué los objetos caen hacia abajo, si no hubiese sido por el evento de la manzana. Observamos eventos en la naturaleza y despiertan nuestra curiosidad para establecer un problema. En trabajos de investigación, el problema se establece en forma de pregunta.
El próximo paso del método científico es la hipótesis. La hipótesis es la posible respuesta a un problema o pregunta de investigación. Para poder establecer una hipótesis debe haber ocurrido una búsqueda de información que le permita explorar el tema que se investiga. Con esa información, el científico establece una posible respuesta al problema en el formato de causa y efecto. Por ejemplo, Si la planta necesita del sol para el proceso de fotosíntesis, entonces la planta que no está expuesta al sol morirá.
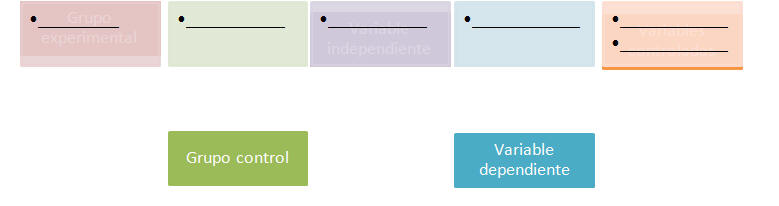
Una vez tenemos la hipótesis, hay que experimentar. Pero los científicos no experimentan sin antes diseñar un procedimiento que sea controlado para que los resultados tengan validez. El diseño de un experimento controlado debe cumplir con ciertos criterios. El primer criterio es que debe tener grupo control y grupo experimental.
El grupo experimental es aquel al que se le dará el tratamiento diferente. El grupo control servirá para comparar. Además de los grupos, un experimento controlado debe tener unos factores que pueden variar o no, los cuales se conocen como variables. Las variables en un experimento son las siguientes: variables controladas, variable independiente o manipulada y la variable dependiente o de respuesta.
La palabra controlada define las variables que se mantienen igual para todos los grupos en un experimento. La variable independiente o manipulada es la condición de tratamiento que se le aplica al grupo experimental; aquello que es diferente entre el grupo experimental y el grupo control. La variable dependiente o de respuesta es el efecto o de la variable independiente.
Cuando se hace un experimento es importante estar atento y hacer observaciones nuevamente. Las observaciones son datos que vamos a recopilar. Los datos recopilados a menudo se organizan en tablas y gráficas para facilitar el siguiente paso, que es el análisis de esos datos.
Cuando analizamos los datos recopilados es necesario compararlos con la información encontrada, previo al experimento y con otros experimentos del mismo tema. Además, determinar si la hipótesis fue aceptada o rechazada. Una vez se hace esto, podemos redactar una conclusión para nuestro experimento. El último paso de la investigación científica es la comunicación, porque no sirve de mucho encontrar la solución a un problema y que nadie lo conozca.
Destrezas y procesos necesarios en química
· Observar – Hacer usos de todos los sentidos.
· Clasificar – Agrupar por características en común.
· Comparar – Observar semejanzas
· Contrastar – Observar diferencias
· Inferir – Llegar a conclusiones basándose en datos o hechos.
· Predecir – Adelantar un posible comportamiento de respuesta o solución.
· Construir – Crear modelos para el análisis.
· Medir – Hacer mediciones.
Calcular – Hacer usos de las matemáticas para llegar a conclusiones
TRABAJO 1 – Método científico. Valor 15 puntos
Instrucciones: Completa el siguiente acróstico con los pasos del método científico
TRABAJO 2 – Variables en un experimento. Valor 15 puntos
Instrucciones: Lee la siguiente situación e identifica los grupos y las variables 
Una compañía farmacéutica desea saber el efecto del tratamiento X sobre la enfermedad Y. Escogen una muestra de personas de la misma edad que padecen la enfermedad. A una parte de esas personas le administran el tratamiento X. La otra parte de las personas toma un placebo (pastilla de azúcar sin el tratamiento X).
TRABAJO 3 – Buscando el personaje perdido. Valor 20 puntos
Instrucciones: Observa detalladamente los personajes a continuación, compara, contrasta, clasifica y encuentra el personaje que falta. Dibuja el personaje perdido con sus características. Puedes imprimir esta hoja para que puedas recortar cada personaje y trabajar la actividad. Para dibujarlo, usa la herramienta “”Paint” en tu computadora


Información conceptual:
TEMA: INSTRUMENTOS DE LABORATORIO 
Esta sección te ayudará a identificar algunos de los instrumentos que se utilizan en un laboratorio de química. A continuación un listado de los principales:
Vaso de precipitado – Su capacidad es en mililitros. Sirve para preparar soluciones, mezclas y para calentar
sustancias.

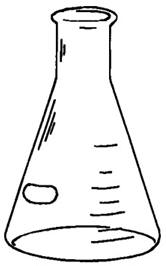
Matraz Erlenmeyer – Capacidad en mililitros. Para preparar soluciones, compuestos, mezclas y calentar. Su cuello es largo, por eso es útil para experimentos con gases.
Probeta – Capacidad en mililitros. Sirven para tomar medidas de líquidos

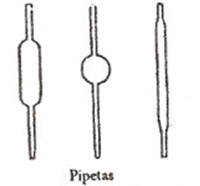
1. Pipeta – Capacidad en mililitros. Sirve para tomar medidas fluidas por succión.
Tubos de ensayo – Para preparar pequeñas cantidades de compuestos, soluciones, mezclas y para almacenar sustancias

Mechero Bunsen – Se utiliza para calentar sustancias que no corren peligro de reaccionar violentamente

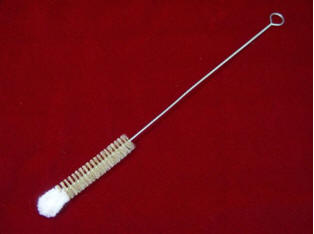
Cepillo de tubo de ensayo – Para limpiar los tubos de ensayo
© Derechos Reservados
Escuela Virtual de Educación Acelerada Proyecto Salón Hogar Inc.
|
