|
|
QUÍMICA
Propiedades de la Materia
Grado 10
MÓDULO 1 - LECCIÓN 2
Información conceptual:
TEMA: LOS ÁTOMOS Y SU ESTRUCTURA

Hoy en día, sabemos que toda la materia está compuesta por átomos, pero esa conclusión ha sido el resultado de las investigaciones de varios científicos que se dieron a la tarea de estudiar la estructura de la materia.
Hace alrededor de 2,500 años atrás, en la época de los griegos, éstos pensaban que la materia se dividía en cuatro elementos: agua, aire, tierra y fuego. No fue hasta el 460-370 aC, que un filósofo, llamado Demócrito, propuso que la materia estaba compuesta de pequeñas partículas, a las que llamó átomosDesarrollo de la Teoría Atómica Moderna
En el 1782, Antoine Lavoisier, hizo medidas de cambios químicos en un envase. Él observó que la masa de los reactivos era igual a la masa de los productos, luego de una reacción química. Este es el principio para la Ley de conservación de la masa y la energía, que establece que la masa y la energía no se crean, ni destruyen; sólo se transforman.
Teoría atómica de Dalton
John Dalton, fue un químico inglés que estudio los resultados de los experimentos de Lavoisier y estableció la Teoría Atómica. La misma establece lo siguiente:

· Toda la materia está hecha de átomos.
· Los átomos son indestructibles y no se pueden separar en partículas más pequeñas.
· Todos los átomos de un elemento son iguales entre sí y diferentes a los átomos de otro elemento.
Esta teoría era casi cierta, pero fue modificada más tarde a medida que nuevos descubrimientos permitieron la compresión de la estructura del átomo.
El electrón
En el 1897, J.J. Thompson descubrió que el modelo de un átomo sólido no era el correcto. Con sus experimentos, descubrió la primera partícula sub atómica, el electrón. El electrón lleva la carga negativa en el átomo.
Protones y neutrones
Luego del descubrimiento del electrón, varios científicos se percataron de que el electrón no era la única partícula en un átomo. Encontraron una partícula que tiene la carga positiva, llamada protón. También descubrieron que en ocasiones los átomos de un elemento no eran todos idénticos entre sí, porque había átomos que no tenían la misma masa. A estos átomos se les conoce como isótopos.
Al descubrir los isótopos, los científicos establecieron la hipótesis de que debía existir una tercera partícula sub atómica, responsable de ese cambio en la masa de los átomos, pero que no tiene ninguna carga. Le llamaron neutrón.
Número atómico y número de masa
El número atómico de un elemento es el número de protones en el interior del núcleo del átomo. Es el número de protones, el que establece las propiedades de cada elemento y permite su organización en la tabla periódica. Por su parte, el número de masa es la suma de los protones y neutrones en el interior del núcleo. Se puede determinar la cantidad de neutrones en un átomo, si sabemos el número de masa y el número atómico, haciendo una simple operación de resta.
Modelo atómico
Se entiende que los protones y los neutrones están en el núcleo del átomo, ¿pero dónde se encuentran los electrones? Los científicos se dieron a la tarea de crear un modelo de la estructura de un átomo. Luego de varios intentos, finalmente se establece el siguiente modelo, que aún se usa en la actualidad
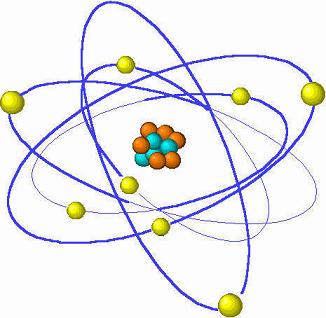
En este modelo se muestra que los electrones están constantemente en movimiento alrededor del núcleo, donde están los protones y neutrones. El lugar donde es más probable que se encuentre un electrón se llama orbital. Cada orbital representa un nivel de energía diferente.
Podemos saber cuántos electrones tiene un elemento si nos dejamos llevar porque cada elemento tiene la misma cantidad de protones, que de electrones. También podemos saber cuántos electrones hay en cada uno de los niveles energéticos, si nos dejamos llevar por el número del periodo de la Tabla Periódica en que se encuentra el elemento.
Electrones de valencia
Los electrones de valencia son los que se encuentran ubicados en el último nivel de energía del átomo o último orbital. Estos electrones son sumamente importantes porque son los que quedan expuestos y determinan las propiedades del átomo y si éste necesita o no unirse a otros átomos para ser estable.
Todos los elementos de la tabla periódica buscan esa estabilidad. Para lograrlo, necesitan tener en su orbital de valencia ocho electrones. Una manera fácil de saber cuántos electrones de valencia tiene un elemento es dejándonos llevar por el último número del grupo al que pertenece. Por ejemplo, los gases nobles, que se encuentran en el grupo 18 de la Tabla Periódica, tienen ocho electrones de valencia cada uno.
Diagrama de puntos de Lewis
Esta es una técnica para representar sólo los electrones de valencia en un diagrama. Se utiliza el símbolo del elemento y se le colocan alrededor puntos representando los electrones de valencia.
Ejemplo: El litio pertenece al grupo I de la Tabla Periódica, por lo tanto tiene un solo electrón de valencia y se representa de la siguiente forma: Li
TRABAJO 1 – Presentación audiovisual
Instrucciones: Busque información en internet sobre el desarrollo de la Teoría Atómica y el modelo del átomo. Prepare una presentación audiovisual de 15 plantillas. Puede utilizar el programa Powerpoint. La siguiente rúbrica se utilizará para evaluar su trabajo: 
TRABAJO 2 – Sistema de puntos de Lewis
Instrucciones: Para cada uno de los siguientes elementos, indique cuántos electrones hay en cada nivel energético. Luego, represente el último nivel con un diagrama de puntos de Lewis: (12 puntos)
1. Argón
2. Magnesio
3. Nitrógeno
4. Aluminio
5. Flúor
6. Azufre
Escoja dos de estos elementos y dibuje un modelo de su estructura atómica. (10 puntos)
Información conceptual:
TEMA: LAS PROPIEDADES Y LOS CAMBIOS FÍSICOS DE LA MATERIA 
¿Qué son las propiedades?
Una propiedad es una característica. Cuando describes un lugar usas adjetivos y mencionas características de ese lugar. Las propiedades de la materia son las características que nos permiten su descripción. Uno de los tipos son las propiedades físicas. Algunas son más útiles para describir unos objetos que otros. Por eso se clasifican en propiedades intensivas y extensivas.
Propiedades extensivas
Son aquellas que dependen de la cantidad de materia en la muestra. La masa, el volumen, la forma y el largo son propiedades extensivas. Algunas de estas propiedades pueden percibirse fácilmente por los sentidos, mientras que otras requieren de la utilización de instrumentos. Para la forma, el color, el sabor no necesitamos instrumentos, pero para volumen y largo sí.
Propiedades intensivas
Estas no dependen de la cantidad de materia. Son independientes de la masa y el volumen y siguen siendo iguales aunque cambie de tamaño la muestra. Algunos ejemplos son la densidad, la temperatura, entre otros. Este tipo de propiedades son muy útiles para identificar sustancias, puesto que son únicas en cada sustancia.
Cambios físicos en la materia
La materia está continuamente cambiando. Cuando estos cambios son físicos, su composición no cambia. Los cambios de estado son ejemplos de cambios físicos por los que atraviesa la materia. Por ejemplo, el agua existe en estado sólido, líquido y gaseoso. Sin embargo, el agua que te tomas y el hielo que le echas al refresco siguen siendo agua, aunque no tengan la misma forma física.
En cada estado de la materia las partículas que la componen varían en cuanto a su distancia. A continuación una ilustración de las partículas de un sólido, de un líquido y de un gas 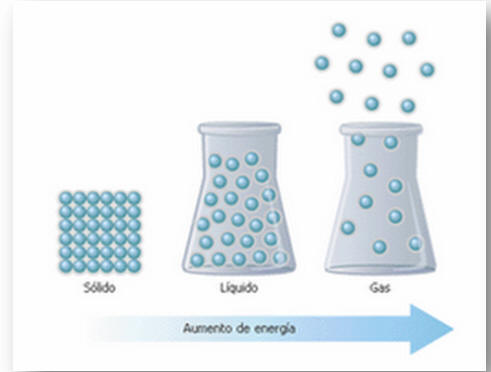
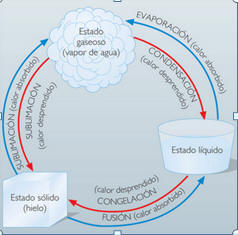
La temperatura juega un papel importante en los cambios de estado. Cuando pones agua en una olla para hacer un sobre de sopa la temperatura va aumentando y así también se van moviendo más rápido sus partículas. Incluso llegas a observar burbujas. Si no vigilas la olla el agua puede desaparecer. ¿Por qué desaparece el agua? Porque pasó de un estado a otro con el aumento en temperatura. A continuación un diagrama de los procesos de cambio de estado:
TRABAJO 1 – Propiedades de la materia
Instrucciones: Identifica las propiedades como intensivas o extensivas. Valor 12 puntos
____1. Temperatura
____2. Forma
____3. Densidad
____4. Color
____5. Olor
____6. Masa
Identifica los cambios de estado que se describen a continuación: Valor 10 puntos
____1. El agua se convierte en vapor.
____2. El oro se derrite.
____3. Unas gotitas de agua en la lata del refresco.
____4. El agua se hace hielo.
____5. Pasar de sólido a gaseoso de inmediato.
Contesta lo siguiente:
1. ¿Para qué nos sirven las propiedades físicas de la materia?
2. ¿Cómo son las partículas de un gas?
3. ¿Cuál es la relación entre la temperatura y los cambios de estado?
TRABAJO 2 – Cambios de estado
Instrucciones: Dibuje un diagrama del proceso de cambios de estado en la materia. Puede utilizar la herramienta paint, láminas, entre otros. Debe identificar los procesos que envuelve los cambios de estado. Se utilizará la siguiente rúbrica de evaluación:

Información conceptual:
TEMA: LAS PROPIEDADES Y LOS CAMBIOS QUÍMICOS 
Cambios químicos
Los cambios químicos siempre envuelven un cambio en la composición de la sustancia. Por ejemplo, cuando hacemos un bizcocho mezclamos unos ingredientes, pero cuando lo exponemos al calor, ocurre un cambio y el producto no es lo mismo que pusimos. Durante un cambio químico, la materia deja de ser lo que era y se convierte en algo nuevo. Las propiedades químicas son aquellas características que describen cómo reacciona una clase de materia al juntarse con otra.
Propiedades químicas
La reactividad es una propiedad química de la materia. Esto es cuando algunas sustancias cambian fácilmente al tener contacto con el aire, agua u otras sustancias. El oxigeno es un elemento sumamente reactivo y se combina con otros elementos para formar muchos de los compuestos importantes para la vida.
La combustibilidad también es una propiedad química de la materia. Esta se refiere a la característica que permite que la materia se inflame y emita luz ante la presencia de aire (oxigeno). No toda la materia es combustible. La combustión es una reacción rápida ante el oxigeno. Esta reacción es la que nos permite cocinar nuestros alimentos y manejar automóviles.
La toxicidad es otra de las propiedades químicas. Se refiere a algunas sustancias que tienen la capacidad de ser tóxicas o nocivas para el ser humano. El monóxido de carbono es un ejemplo de un gas tóxico. Este gas es emitido por los automóviles.
Reacciones químicas
Las reacciones químicas son cambios químicos porque una vez ocurren, la sustancia no vuelve a ser la misma. Hay varios indicadores para las reacciones químicas, pero de eso hablaremos más adelante en el curso.
TRABAJO 1 – Collage de las propiedades químicas de la materia.
Instrucciones: Con la información anterior, busque imágenes en internet y prepare un montaje fotográfico que muestre las propiedades químicas de la materia: reactividad, toxicidad y combustibilidad. Debe incluir una lista de las direcciones electrónicas de donde obtuvo las imágenes.
La siguiente rúbrica se utilizará para evaluar su trabajo:

Información conceptual:
TEMA: EL CALOR Y LA TEMPERATURA

El calor y la temperatura
Todos sabemos lo que es el calor, pues vivimos en una isla tropical. Pero el calor se define como una transferencia de energía.
El calor se va moviendo desde puntos más calientes a puntos más fríos. La transmisión del calor ocurre por medio de procesos físicos. La conducción es un ejemplo. La conducción ocurre cuando los objetos que tienen distinta temperatura entran en contacto. La temperatura es la medida del calor de la materia. Cuando sube la temperatura las partículas de la materia se mueven rápidamente y liberan energía. Un ejemplo de conducción es cuando tocas una hornilla caliente, tu mano se quema porque hubo una transferencia del calor por contacto o conducción

Hay sustancias que son buenos conductores de calor y hay otras que no. A las sustancias que conducen bien el calor se les llama
conductores. Los que aíslan el calor se llaman aislantes. Ambos son muy útiles en la electricidad. Otra forma de transferencia de calor es la convección. En esta el calor es transportado por medio de algún fluido. Esto es lo que ocurre cuando se calienta agua en un envase.
TRABAJO 1 – Transferencia de calor
· Reacciona a lo siguiente en un ensayo de tres párrafos. Puedes buscar información adicional para sustentar tus argumentos.
Cuando calientas una sopa, ¿a qué se debe el movimiento de los fideos?
Se utilizará la siguiente rúbrica para evaluar la redacción del párrafo:

© Derechos Reservados
Escuela Virtual de Educación Acelerada Proyecto Salón Hogar Inc.
|
