|
|
QUÍMICA
Tabla Periódica de los Elementos
Grado 10
MÓDULO 1 - LECCIÓN 3
TABLA DE CONTENIDO
Módulo III – Tabla periódica de los elementos
Instrucciones de ejecución
Objetivos del módulo
Desarrollo de la Tabla Periódica
Propiedades periódicas de los elementos
Laboratorio: El pH de diferentes sustancias
Leyes de gases
Referencias
Bienvenido al Módulo III del curso de Química.
Este módulo le guiará para el desarrollo de las destrezas y conceptos principales dentro del estudio de los procesos dinámicos que le ocurren a la materia. Para empezar, es importante que tenga acceso a una computadora con servicio de internet. Esto le servirá para la búsqueda de información y el análisis de los temas desarrollados en este módulo. A continuación, unos pasos que le ayudarán a ejecutar correctamente:
En cada tema encontrará una información conceptual. Deberá leer dicha información para luego realizar actividades de aplicación.
Las actividades de aplicación son variadas. En algunas ocasiones se le requerirá que vaya a alguna página de internet para buscar información. En ese caso, la dirección aparecerá en las instrucciones de la actividad. Las ciencias son una disciplina práctica, por lo que también se le requerirá realizar varios procedimientos experimentales sencillos con materiales de fácil acceso. Una vez termine la experiencia, deberá realizar un informe de laboratorio, siguiendo las instrucciones que aparecerán en cada actividad. Recuerde que debe ser cuidadoso y guardar precauciones de seguridad en todo momento al realizar los experimentos asignados. Siga trabajando los temas en el orden establecido, ya que el curso está preparado y organizado para cumplir con el tiempo lectivo de noventa horas (22.5 horas por módulo).
Espero que esta experiencia de aprendizaje sea fructífera y que podamos lograr los objetivos del curso de Química de undécimo grado.
Objetivos generales
· El estudiante logrará obtener conocimiento de la química, como rama de las ciencias físicas.
· El estudiante logrará reconocer las características y los cambios que le ocurren a la materia.
· El estudiante logrará tomar decisiones para la solución de situaciones de la vida diaria
· El estudiante podrá explorar intereses profesionales orientados a las ciencias.
Objetivos específicos del Módulo III
Identifica y explica las propiedades que determinan la organización de los elementos en periodos y familias en la Tabla Periódica.
Amplía su conocimiento de la Tabla Periódica y establece que los elementos se ordenan por el número de protones en el núcleo.
Discute el desarrollo histórico de la Tabla Periódica como un método para ordenar y clasificar los elementos a base de sus propiedades.
Destaca las contribuciones de Dobereiner, Newland y Mendeléiev a la organización periódica de los elementos.
Reconoce que la Tabla Periódica es adoptada por acuerdo internacional para clasificar los elementos y que es idéntica en todos los idiomas.
Identifica usos prácticos y aplicaciones tecnológicas de algunos elementos (metales, no metales y metaloides).
Explica la formación de enlaces iónicos con modelos atómicos, estructura de símbolos electrónicos y configuración electrónica.
Define pH.
Toma medida del pH en diferentes sustancias.
Compara el pH de distintas sustancias comunes.
Explica la relación entre el volumen de un gas, la presión y temperatura en que se encuentre.
Aplica las leyes de los gases para explicar los efectos de los cambios en presión, temperatura y volumen en situaciones como la construcción de aeróstatos, los cambios climáticos y los tanques de buceo, entre otras.
Información conceptual
TEMA: DESARROLLO DE LA TABLA PERIÓDICA
La Tabla Periódica tal como la conocemos hoy día, es el resultado de las aportaciones de varios científicos quienes se dieron a la tarea de agrupar los elementos tomando en consideración las propiedades de los mismos.
Berzelius
En el año 1813, Berzelius clasificó los elementos naturales en dos grandes grupos: metales y no metales. Los elementos metálicos eran los que tenían brillo característico, eran maleables y conducían bien el calor y la electricidad. Los no metales eran los que tenían diversos aspectos físicos y no conducían electricidad.
Triada de Dӧbereiner
En el año 1829, el científico alemán Dӧbereiner estableció un intento de clasificación más sistemático, agrupando los elementos de tres en tres. Estos grupos se conocen con el nombre de triadas. En estas, el elemento central tenía una masa atómica cercana a la media aritmética (promedio) de la de los extremos. Solo pudo ordenar nueve elementos de esta forma, pero su trabajo sentó precedentes.
Jean-Baptiste Dumas
Este científico clasificó los elementos en metales y metaloides, estableciendo cinco familias: H, F, O, N y C.
Alexander B. de Chancourtois
En 1862, este científico construyó su anillo telúrico, en el que los elementos estaban situados por orden creciente de peso atómico en una hélice, cuyos puntos diferían en 16 unidades.
John A. Newlands
En el 1865, Newlands ordenó los elementos en orden creciente de pesos atómicos, observando que el octavo elemento se parecía al primero (ley de las octavas). Esta clasificación tenía un problema porque algunas filas eran muy dispares y no había lugar para elementos recién descubiertos.
J. Lothar Meyer
Organizó la tabla teniendo en cuenta los volúmenes atómicos. (1830 – 1895).
D. I. Mendeléiev
En el año 1970, este científico publicó la tabla periódica que dio paso a la que utilizamos actualmente. Esto lo hizo siguiendo la idea de Newlands de organizar los elementos en orden creciente, pero perfeccionó la organización dejando un espacio en blanco cuando el elemento no encajaba por el peso atómico. También se formó el grupo de los metales de transición.
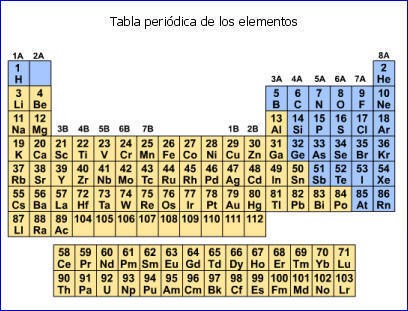
Sistema periódico actual
Actualmente, la tabla periódica agrupa los elementos tomando en cuenta dos criterios de forma simultánea:
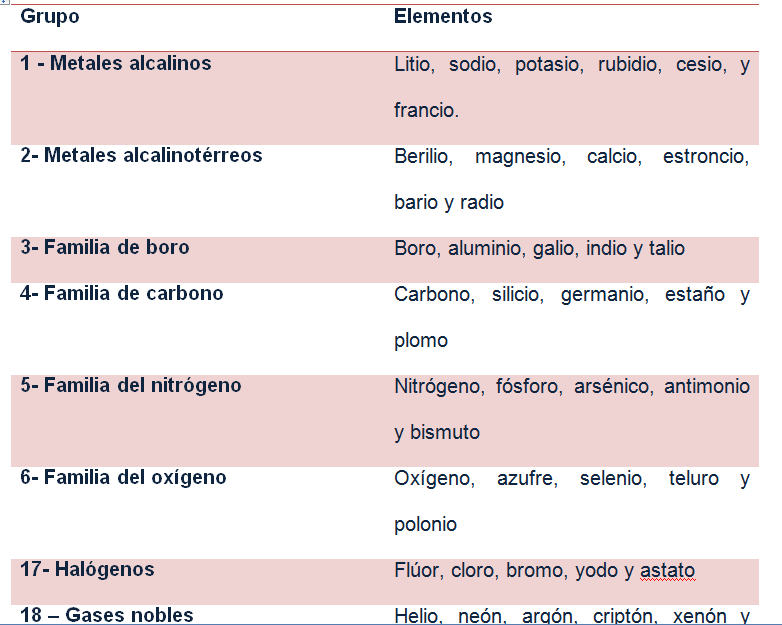
· Las líneas horizontales se llaman periodos. Se colocan los elementos en orden ascendente de número atómico.
· Las líneas verticales se llaman familias o grupos. Se colocan los elementos de propiedades semejantes.
Esta organización hace que la tabla periódica sea un instrumento imprescindible para el estudio de la materia, porque muchas de las propiedades de los elementos químicos tienen que ver con su ubicación en la tabla periódica.
Descripción de la Tabla Periódica actual
Los elementos de la tabla periódica se pueden clasificar en metales, no metales y gases nobles. Los elementos que están en el último grupo de la tabla se conocen con el nombre de gases nobles. Se les llama así porque tienen su nivel más externo completamente lleno con ocho electrones de valencia. Por esa razón, no necesitan unirse a ningún elemento para conseguir su estabilidad.
Los elementos que se encuentran al lado izquierdo de la tabla llevan el nombre de metales. Los metales son prácticamente todos sólidos en condiciones ambientales, menos el mercurio que es el único metal líquido.
Los no metales, por su parte, se pueden encontrar en los tres estados de la materia. Por ejemplo, el bromo es líquido, pero el oxigeno es un gas y el yodo es sólido.
Hay unos elementos que comparten propiedades de metales y no metales. A estos se le conoce con el nombre de metaloides. Los elementos que están en la debajo en la tabla se conocen con el nombre de metales de transición (actínidos y lantánidos).
TRABAJO 1 – Aportaciones científicas al desarrollo de la tabla
periódica

TRABAJO 2 – Preguntas de discusión
Instrucciones: Conteste las siguientes preguntas.
1. ¿Cómo ha evolucionado la Tabla Periódica? (5 pts.)
2. ¿Cuál es la importancia de la tabla periódica de los elementos? (5 pts.)
Pegue una lámina de la tabla periódica actual encontrada en internet. (5 pts.) Incluya referencia.
Información conceptual:
TEMA: PROPIEDADES PERIODICAS DE LOS ELEMENTOS

Propiedades periódicas
Las principales propiedades periódicas de los elementos son:
· Configuración electrónica
· La energía de ionización
· La afinidad electrónica
· La electronegatividad
· El volumen atómico
M · El carácter metálico o no metálico
· El número de oxidación
Configuración electrónica
Como se indicó en el módulo anterior, los electrones se encuentran en niveles o capas de energía. Los elementos de un mismo periodo tienen el mismo número de niveles electrónicos u orbitales. Cada nivel o capa puede tener uno o más subniveles con distinto número de electrones. A continuación los subniveles y el número de electrones posible en cada nivel: 
La configuración electrónica es como la dirección para hallar un elemento en la tabla periódica. Imagina que la tabla es una gran urbanización y que cada periodo son calles. En cada calle hay ciertos niveles (s, p, f, d) y cierta cantidad de casas (elementos). Para escribir la configuración electrónica de un elemento, primero colocamos el número de nivel y luego el subnivel con el número de electrones que lo ocupan. Por ejemplo: 1s2, 2s2p6 es la configuración electrónica de neón. Si observamos la tabla, podemos interpretar esta configuración como la siguiente dirección: para llegar a neón, comenzamos en la calle 1, donde hay dos casas (hidrogeno y helio). Luego, en la calle 2 del nivel s hay dos casas (litio y berilio). Llegamos al nivel p de la calle 2, donde la sexta casa es la de neón.
A continuación, se muestra una tabla periódica con los subniveles marcados para que la puedas utilizar para construir la configuración electrónica de algunos elementos. 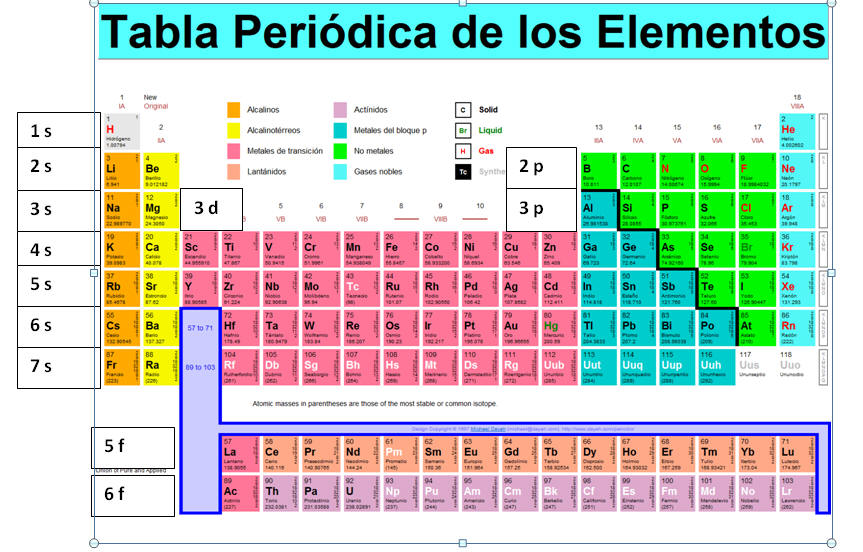
Note que los elementos de transición comienzan con la calle 3d y así sucesivamente
Electronegatividad
La electronegatividad de un elemento varía de acuerdo a su ubicación en la tabla periódica. Así, los elementos más electronegativos son aquellos que se encuentran más arriba y a la derecha de la tabla. Los que están más abajo y a la izquierda son menos electronegativos. Los gases nobles no tienen electronegatividad porque son inertes. La electronegatividad es una tendencia que tienen los átomos del elemento para captar o tomar electrones.
Número de oxidación
El número de oxidación de un elemento es la cantidad de electrones que gana, cede o comparte cuando se une con otro elemento. En ocasiones, el mismo elemento puede actuar con distintos números de oxidación, dependiendo del elemento con el que se esté uniendo en un compuesto. Este número está relacionado con la configuración electrónica. En un mismo grupo, los elementos suelen tener números de oxidación comunes. El número de oxidación coincide con el número del grupo al que pertenece. Así, el litio, sodio y cesio tienen número de oxidación uno, porque pertenecen al grupo 1 de la tabla periódica.
TRABAJO 1 – Preguntas
Instrucciones: Conteste las siguientes preguntas con la información provista.
1. ¿A qué elemento se parecerá más oxigeno químicamente hablando, a fósforo o a azufre? Explique. (10 pts.)
2. Indica cuál elemento es más electronegativo en los siguientes grupos: (10 pts.)
· Rubidio y sodio
· Nitrógeno y flúor
· Yodo y oxigeno
· Calcio e hidrógeno
· Silicio y carbono
TRABAJO 2 – Configuración electrónica
Instrucciones: Use la tabla periódica provista previamente y escriba la configuración electrónica de los siguientes elementos: (30 puntos)
· Estroncio
· Calcio
· Potasio
· Fósforo
· Oxigeno
· Nitrógeno
· Carbono
· Aluminio
· Argón
· Cobre
TRABAJO 3 – Revista de elementos. Valor 100 puntos
Instrucciones: Busque la siguiente información de cada uno de los elementos para completar la tabla:
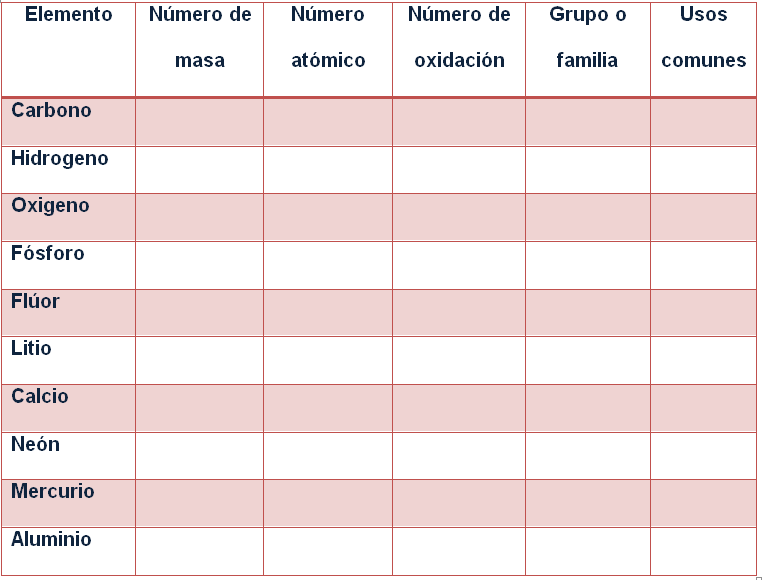
Luego, construya una revista en Word, Powerpoint o Publisher de los elementos de la tabla anterior. En cada página deberá aparecer la información de cada elemento con una lámina o fotografía que se relacione con el mismo.
TEMA: LABORATORIO DE QUÍMICA
Título: El pH de diferentes sustancias

Materiales:
· Sustancias líquidas comunes
· Medidor de pH
· Servilletas
· Vasos de análisis
Procedimiento:
· La maestra te asignará unas muestras líquidas.
· Utiliza el medidor de pH para verificar la medida de pH. Anota en la tabla tus datos.
TABLA DE DATOS
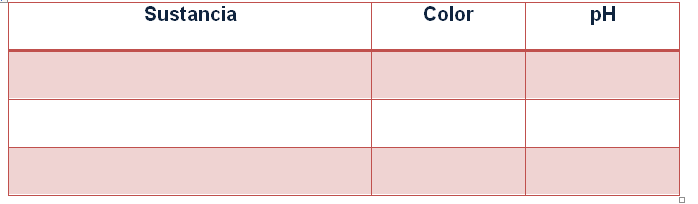
Preguntas:
1. Compara el pH de las distintas sustancias. ¿Qué sustancias son ácidas? ¿Cuáles son básicas?
¿Cómo se relaciona este laboratorio con lo aprendido en el curso de química?
Información conceptual:
TEMA: LEYES DE LOS GASES

Diariamente estamos rodeados de gases. La atmósfera es una capa de gases que cubre la Tierra y protege que se mantenga en la temperatura que permite la vida. Por eso es importante que aprendamos cómo se comportan los gases.
Propiedades de los gases
· No tienen forma definida.
· Se expanden para ocupar un espacio.
· Son fluidos.
· Sus partículas se mueven rápidamente y en todas direcciones.
· Baja densidad.
· Se pueden comprimir.
· Se mezclan fácilmente.
Leyes de gases
El volumen de un gas es el mismo del envase que lo contiene, pero debemos tomar en consideración el factor presión. Las leyes de los gases describen el comportamiento de un gas y cómo este se afecta por la presión y la temperatura.
Ley de Boyle
Un buzo a 10 metros sopla una burbuja de aire. Al llegar a la superficie, la burbuja tendrá el doble del volumen porque la presión disminuye. Mientras más profundo entramos en el mar, mayor es la presión. La relación entre el volumen de un gas y su presión se conoce como la Ley de Boyle. Dicha ley establece que para una cantidad de gas a temperatura constante, el volumen aumenta mientras su presión disminuye y viceversa. Esto puede ser expresado con la siguiente fórmula:
P1V1 = P2V2
P = presión; V = volumen
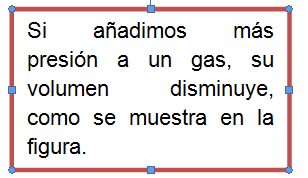
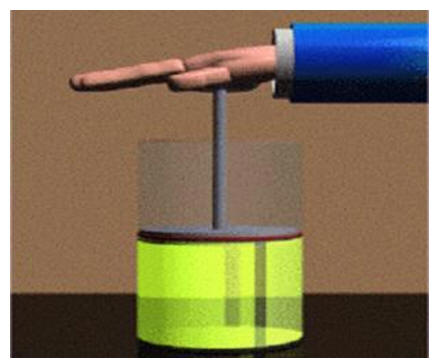
Ley de Charles
¿Cómo puedes explotar un globo sin ejercerle presión? Calentándolo. Cuando aumenta la temperatura de un gas, sus partículas comienzan a moverse vigorosamente y esto hace que su volumen aumente. La Ley de Charles establece que un gas a presión constante aumenta su volumen cuando aumenta su temperatura.
Ejercicios con la Ley de Boyle
Podemos hacer uso de la fórmula de la Ley de Boyle para determinar una variable desconocida. Analice el siguiente ejemplo:
El gas de un globo tiene un volumen de 7.5L a una presión de 100kPa. El globo se suelta a la atmósfera y el gas expande su volumen a 11L. Asume que hay temperatura constante. ¿Cuál es la presión del gas en el globo a este nuevo volumen?
· Primero debemos establecer y separar los datos de la siguiente forma:
Volumen 1 = 7.5L Presión 1 = 100 kPa
Volumen 2 = 11L Presión 2 = ?
· Luego, establece la fórmula que usarás para resolver el
problema:
P1V1 = P2V2
· En este caso, necesitamos la presión 2, por lo que será necesario despejar para esa variable. La fórmula resultante será:
P2 = P1V1 / V2
· Sustituye las variables por los valores dados en el problema y resuelve.
TRABAJO 1 – Ejercicios Ley de Boyle
Instrucciones: Resuelve los siguientes ejercicios utilizando la fórmula para la Ley de Boyle. Valor 20 puntos.
1. Si la presión ejercida sobre una muestra de hidrógeno es de 300mL a una temperatura constante aumenta de 0.500 atm a 0.750 atm, ¿cuál será el volumen final del gas?
2. Un globo de helio tiene un volumen de 5.0L a una presión de 101.3 kPa. El globo se suelta y alcanza una altitud de 6.5 km a una presión de 50.7 kPa. Si el gas permanece a la misma temperatura, ¿cuál es el nuevo volumen del globo?
3. Una muestra de oxigeno tiene un volumen de 150 mL a una presión de 0.947 atm. ¿Cuál será el volumen del gas si la temperatura es constante y llega a una presión de 1.000 atm
4. Un cilindro con un volumen de 0.15L contiene un gas con presión de 150 kPa. Si un pistón comprime el gas a una temperatura constante y un volumen de 0.025L, ¿cuál será la nueva presión del gas?
TRABAJO 2 – Experimento sencillo
Instrucciones: Sigue las instrucciones para realizar el experimento y documentar tus datos.
Título: ¿La temperatura afecta el volumen de un gas?
Materiales:
· 2 bandejas de aluminio
· Hielo
· Globo
· Hornilla
· Beaker de 250 ml o vaso con esa medida
· Regla
· Guantes
· Agua
Procedimiento:
1. Llene una de las bandejas con 5 cm de agua y coloque en la hornilla.
2. Llene la otra bandeja con 5 cm de agua con hielo.
3. Llene el globo dentro del vaso. El tamaño debe ser hasta que llene el espacio entre el vaso, pero que no sobresalga del vaso. Haga un nudo para cerrar el globo.
4. Coloque el vaso y el globo dentro de la bandeja de agua con hielo. Haga una tabla de datos y anote las observaciones.
5. Saque el vaso con el globo y observe por varios minutos. Anota si hay cambios.
6. Coloque el vaso con el globo en la bandeja de agua caliente y observe qué sucede.
Análisis
¿Cómo el cambio en la temperatura afecta el volumen de un globo?
¿Se afecta la densidad de un gas por el cambio en temperatura? 
© Derechos Reservados
Escuela Virtual de Educación Acelerada Proyecto Salón Hogar Inc.
|
