|
|
QUÍMICA
Propiedades de la Materia

Grado 10
MÓDULO - 2
TABLA DE CONTENIDO
Módulo II – Propiedades de la materia
Instrucciones de ejecución
Objetivos del módulo
Clasificación de la materia
Átomos y su estructura
Propiedades y cambios físicos
Propiedades y cambios químicos
Calor y temperatura
Referencias
Bienvenido al Módulo II del curso de Química.
Este módulo le guiará para el desarrollo de las destrezas y conceptos principales dentro del estudio de los procesos dinámicos que le ocurren a la materia. Para empezar, es importante que tenga acceso a una computadora con servicio de internet. Esto le servirá para la búsqueda de información y el análisis de los temas desarrollados en este módulo. A continuación, unos pasos que le ayudarán a ejecutar correctamente:
ü En cada tema encontrará una información conceptual. Deberá leer dicha información para luego realizar actividades de aplicación.
ü Las actividades de aplicación son variadas. En algunas ocasiones se le requerirá que vaya a alguna página de internet para buscar información. En ese caso, la dirección aparecerá en las instrucciones de la actividad.
ü Las ciencias son una disciplina práctica, por lo que también se le requerirá realizar varios procedimientos experimentales sencillos con materiales de fácil acceso. Una vez termine la experiencia, deberá realizar un informe de laboratorio, siguiendo las instrucciones que aparecerán en cada actividad.
ü Recuerde que debe ser cuidadoso y guardar precauciones de seguridad en todo momento al realizar los experimentos asignados.
ü Siga trabajando los temas en el orden establecido, ya que el curso está preparado y organizado para cumplir con el tiempo lectivo de noventa horas (22.5 horas por módulo).
Espero que esta experiencia de aprendizaje sea fructífera y que podamos lograr los objetivos del curso de Química de undécimo grado.
Objetivos generales
· El estudiante logrará obtener conocimiento de la química, como rama de las ciencias físicas.
· El estudiante logrará reconocer las características y los cambios que le ocurren a la materia.
· El estudiante logrará tomar decisiones para la solución de situaciones de la vida diaria
· El estudiante podrá explorar intereses profesionales orientados a las ciencias.
Objetivos específicos del Módulo II
· Describe la materia a base de sus propiedades características.
· Reconoce que la diversidad de la materia surge de la formación de compuestos químicos a base de un número relativamente pequeño de elementos.
· Describe, explica e interpreta la estructura de la materia basado en el concepto átomo.
· Describe los experimentos que llevaron al descubrimiento de algunas partículas subatómicas como los experimentos de J.J. Thomson, de Robert Millikan y de Ernest Rutherford, entre otros.
· Describe y explica los diferentes modelos atómicos que se han postulado.
· Utiliza el modelo actual del átomo para explicar la estructura y propiedades de éste y su relación con las propiedades de la materia.
· Compara y contrasta las ideas de la teoría atómica.
· Utiliza diagramas “punto-electrón” (diagramas de Lewis) para explicar la distribución de los electrones de valencia en el átomo.
· Explica la distribución espacial de las partículas en los estados sólido, líquido y gaseoso.
· Representa con modelos físicos o diagramas el movimiento de las partículas en los estados sólido, líquido y gaseoso.
· Discrimina entre las propiedades físicas extensivas e intensivas de la materia.
· Define operacionalmente el concepto densidad.
· Describe la materia a base de sus propiedades características.
· Distingue entre un cambio físico y un cambio químico.
· Relaciona el contenido de energía térmica de un material con el movimiento de las partículas que lo constituyen de acuerdo a la teoría cinético-molecular.
· Explica el concepto temperatura en términos del contenido de energía cinética promedio de las partículas.
Información conceptual
Colaboración
Proyecto Salón Hogar
La química actúa sobre la materia, que es todo aquello que nos rodea, ocupa un lugar y un espacio en el universo, y que somos capaces de identificar y conocer. La materia presenta dos tipos de propiedades: propiedades extensivas y propiedades intensivas.
|
Las propiedades extensivas se relacionan con la estructura química externa; es decir, aquellas que podemos medir con mayor facilidad y que dependen de la cantidad y forma de la materia. Por ejemplo: peso, volumen, longitud, energía potencial, calor, etcétera. Las propiedades intensivas, en cambio, tienen que ver más con la estructura química interna de la materia, como la temperatura, punto de fusión, punto de ebullición, calor específico o concentración (ver glosario para estos tres últimos términos), índice de refracción, entre otros aspectos.
Las propiedades intensivas pueden servir para identificar y caracterizar una sustancia pura, es decir, aquella que está compuesta por un solo tipo de molécula (ver glosario), como, por ejemplo, el agua, que está formada solo por moléculas de agua (H2O), o el azúcar, que solo la conforman moléculas de sacarosa (C12H22O11).
Sólido, líquido y gaseoso
La materia normalmente presenta tres estados o formas: sólida, líquida o gaseosa. Sin embargo, existe un cuarto estado, denominado estado plasma, el cual corresponde a un conjunto de partículas gaseosas eléctricamente cargadas (iones), con cantidades aproximadamente iguales de iones positivos y negativos, es decir, globalmente neutro.
El estado sólido se caracteriza por su resistencia a cualquier cambio de forma, lo que se debe a la fuerte atracción que hay entre las moléculas que lo constituyen; es decir, las moléculas están muy cerca unas de otras.
En el estado líquido, las moléculas pueden moverse libremente unas respecto de otras, ya que están un poco alejadas entre ellas. Los líquidos, sin embargo, todavía presentan una atracción molecular suficientemente firme como para resistirse a las fuerzas que tienden a cambiar su volumen.
En cambio, en el estado gaseoso, las moléculas están muy dispersas y se mueven libremente, sin ofrecer ninguna oposición a las modificaciones en su forma y muy poca a los cambios de volumen. Como resultado, un gas que no está encerrado tiende a difundirse indefinidamente, aumentando su volumen y disminuyendo su densidad.
La mayoría de las sustancias son sólidas a temperaturas bajas, líquidas a temperaturas medias y gaseosas a temperaturas altas; pero los estados no siempre están claramente diferenciados. Puede ocurrir que se produzca una coexistencia de fases cuando una materia está cambiando de estado; es decir, en un momento determinado se pueden apreciar dos estados al mismo tiempo. Por ejemplo, cuando cierta cantidad de agua llega a los 100ºC (en estado líquido) se evapora, es decir, alcanza el estado gaseoso; pero aquellas moléculas que todavía están bajo los 1001C, se mantienen en estado líquido.
Cambios físicos y químicos de la materia
Aunque al mirar a nuestro alrededor podemos apreciar distintos estados de la materia (por ejemplo, una silla es materia en estado sólido, la leche un líquido y el humo de las fábricas es gaseoso), en la naturaleza ocurren infinitos cambios a cada instante.
Si tomamos, por ejemplo, un vaso con agua (estado líquido), observaremos que el agua ocupa el espacio interno del vaso. Luego, si colocamos en un recipiente el agua contenida en el vaso y la calentamos, veremos que en cierto momento comienzan a observarse burbujas en la superficie, y el agua en estado líquido pasa a ser vapor de agua (estado gaseoso). Este evento, que es común observar en nuestra vida diaria, corresponde a un cambio de estado de la materia.
El agua, tanto en estado líquido como en estado gaseoso, presenta la misma composición química (H2O). Los cambios de estado de cualquier material en los que su composición química permanece invariable se denominan cambios físicos.
Ahora, si tenemos agua mezclada con azúcar (agua azucarada) y la calentamos hasta evaporar toda el agua posible, en el recipiente queda el azúcar; es decir, se obtienen los materiales iniciales: agua (ahora en forma de vapor) y azúcar. Así, cuando mezclamos dos materiales y podemos separarlos por procedimientos físicos, entonces el cambio ocurrido también es un cambio físico. Otros tipos de cambios físicos pueden ser patear una pelota o romper una hoja de papel. En todos los casos podría cambiar la forma, como cuando cortas el papel, pero la sustancia se mantiene, es decir, el papel sigue estando ahí.
Pero existe otro tipo de cambio que sí modifica la estructura química de uno o más materiales. Es el que se conoce como cambio químico. Este sucede cuando el material experimenta una transformación en su estructura química, como consecuencia de su interacción o relación con la estructura química de otro material, transformándose ambas estructuras. Esto da como resultado la formación de un nuevo material con características diferentes a las iniciales; es decir, ocurrió una reacción química.
|
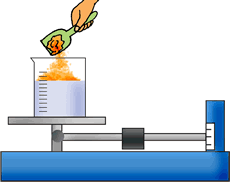
En el experimento de la manzana se puede apreciar un cambio químico, ya que sus constituyentes externos reaccionaron con el oxígeno del aire y se produjo un oscurecimiento por la reacción de oxidación (ver glosario) o envejecimiento. Su estructura interna cambió y ya no es posible recuperarla por medios físicos, por ejemplo, cortar la parte oxidada, ya que solo se obtendría un tejido vegetal nuevo.
Las frutas, como las manzanas, pueden conservarse por refrigeración, que hace más lento el proceso de oxidación, o cubriéndolas, para que el oxígeno no actúe sobre la fruta. En el experimento, como habrás podido apreciar, el trozo de manzana cubierto con el plástico no se oscureció. Tampoco la parte de la manzana impregnada con jugo de limón se alteró. Es más, seguirá en buen estado, ya que el jugo de limón contiene vitamina C (ácido ascórbico), la cual actúa como antioxidante; es decir, evita que el oxígeno reaccione con la manzana y retarda el envejecimiento. El tercer trozo, al estar sin jugo de limón y sin plástico (es decir, al estar expuesto al oxígeno del aire) se oscureció, evidenciando una reacción de oxidación, la misma que corresponde a un cambio de estado de tipo químico.
En la naturaleza, la mayoría de las alteraciones que se producen son cambios químicos, como la combustión, la pudrición, la fermentación, la digestión de los alimentos, etcétera.
Sin embargo, también existen otros tipos de transformaciones químicas, como cuando se quema basura, o uno fundamental, que es la respiración, donde hay una reacción química.
Así como la manzana, otras frutas experimentan las mismas modificaciones, como, por ejemplo, el plátano y la palta. Tú mismo puedes repetir el experimento usando otras frutas o verduras, haciendo comparaciones y verificando lo que sucede. Incluso puedes invitar a tus amigos para que cada uno elija una fruta o verdura y después comparen y discutan los resultados de cada uno.
Así, aplicarás también el método científico (observación, problema, hipótesis y experimentación).
Mezclando sustancias
Proyecto Salón Hogar
 Ya sabes que todo lo que existe en el universo está compuesto por materia. Esta, a su vez, se clasifica en mezclas y sustancias puras. Las sustancias puras comprenden un solo compuesto, y las mezclas son combinaciones de sustancias puras en proporciones variables o diferentes; por ejemplo, una mezcla de arena y sal.
Ya sabes que todo lo que existe en el universo está compuesto por materia. Esta, a su vez, se clasifica en mezclas y sustancias puras. Las sustancias puras comprenden un solo compuesto, y las mezclas son combinaciones de sustancias puras en proporciones variables o diferentes; por ejemplo, una mezcla de arena y sal.
Los compuestos están conformados por los elementos (como, por ejemplo, el hidrógeno y el oxígeno, que forman el agua), los cuales existen en los compuestos en una proporción definida, es decir, en cantidades suficientes que permiten que dichos elementos se mantengan siempre estables y que también impiden su separación por métodos físicos. Por ejemplo, si se hace reaccionar sodio (Na) con cloro (Cl2) se obtendrá Na1Cl1 exclusivamente y no sustancias tales como Na0.5Cl2.3 o mezclas raras.
Las mezclas se clasifican en homogéneas (soluciones) y en heterogéneas. En una mezcla homogénea no hay distinción de fases, es decir, de una porción de la sustancia pura. Es el caso, por ejemplo, del agua con alcohol, el agua azucarada o el agua con café, donde se observa una sola fase: la líquida. Además, en este tipo de mezcla los componentes se unen hasta el nivel molecular, de manera que no es posible distinguirlos. Por ejemplo: oxígeno en agua o sal en agua. También existen las soluciones sólidas (mezcla de metales), llamadas aleaciones.
En las soluciones hay dos sustancias involucradas: una que disuelve, solvente, y otra que se disuelve, el soluto. Cuando mezclamos agua (solvente) con azúcar, tenemos que cada molécula de azúcar (soluto) queda rodeada por varias moléculas de agua. Lo mismo sucede en otras soluciones. Por esta razón, una vez que han sido mezclados no podemos diferenciar a simple vista el soluto del solvente.
En cambio, en una mezcla heterogénea pueden distinguirse con facilidad las diferentes fases que forman la mezcla. Por ejemplo, el agua con arena. Aquí se forman dos fases: una fase sólida, conformada por la arena, y otra fase líquida, constituida por el agua. Otros ejemplos son el agua con aceite, sal y arena, entre otros.
Las mezclas pueden separarse en sus componentes por procesos físicos, mientras que los compuestos se separan en sus constituyentes por procesos químicos.
En cualquier caso, la mezcla de materiales es un proceso que utilizamos a diario, tanto en la cocina (al mezclar los ingredientes de una torta) como en las industrias altamente tecnificadas (como la farmacéutica). En la naturaleza también encontramos mezclas, como la sangre, la orina y el aire.
|
La materia. Propiedades características. Este tema trata de las propiedades llamadas características, porque son específicas para cada sustancia pura; por ello puede identificarse una sustancia desconocida, ya que pueden reconocerse sus propiedades y luego compararlas con las que en literatura química se describen como características de las sustancias conocidas. |
|||||||
|
|||||||
|
|||||||
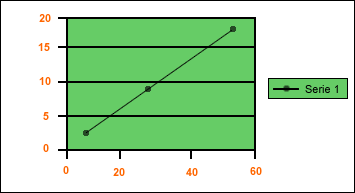
Pero también podemos analizar y determinar la densidad mediante una gráfica de masa en función del volumen en la cual, al unir los puntos correspondientes, resulta una línea recta cuya pendiente es la densidad.
|
|||||||
| Ejemplo: Calcular la densidad de una muestra de oro de 120 g. que ocupa un volumen de 3 cm 3. D = m / v ; D = 120 g / 3 cm 3 = 40 g/cm 3 | |||||||
|
|||||||
| Solubilidad: Para entender bien el concepto de solubilidad tenemos que saber : qué es soluto y qué es solvente. | |||||||
 |
|||||||
| Todo depende de la naturaleza del soluto, del solvente, y de la temperatura; podemos mencionar una regla muy popular en química que dice: “lo semejante disuelve a lo semejante”, de esta manera podemos decir que el esmalte de uñas se disuelve en acetona pero no en agua, debido a que el esmalte de uñas es compatible con la acetona mas no con el agua. Una sustancia puede ser muy soluble en un solvente e insoluble en otro.
¿Cómo se determina la solubilidad? |
|||||||
|
|||||||
| El peso se expresa en Newton. Dada esta definición de peso concluimos que el peso y la masa no son iguales; la masa puede permanecer constantemente pero el peso varía de acuerdo con la gravedad de los cuerpos. | |||||||
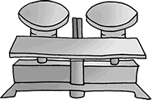 |
¿Cómo se mide la masa? La masa se mide con un instrumento llamado balanza; el procedimiento para medir la masa en una balanza debe tomar en cuenta el estado físico del material. |
||||||
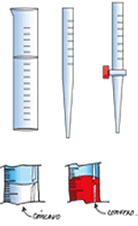
| ¿Cómo se mide el volumen? El volumen se mide en cualquier instrumento volumétrico; puede ser el cilindro graduado, la pipeta, la bureta u otro similar; en todo caso la lectura correcta del volumen en el instrumento debe tomar en cuenta la posición del menisco. |
 |
||||||
TEMA: CLASIFICACIÓN DE LA MATERIA

Química y materia
La química es la ciencia que estudia la materia. Como materia se entiende todo aquello que tiene masa y ocupa un espacio. Prácticamente todo lo que nos rodea es materia.
Cuando hablamos de la estructura de la materia nos referimos a su composición y cómo se organiza. Las propiedades de la materia describen las características y el comportamiento de la materia, incluyendo los cambios que ocurren en ella.
Estudiar la materia
Para estudiar la materia se pueden examinar sus características macroscópicas y microscópicas. También se puede hacer uso de modelos representativos, puesto que facilita la compresión.
Clasificación de la materia
Una gota de agua, las estrellas, los libros, los alimentos, entre otros, son ejemplos de materia, pero no toda la materia es igual. Por eso, existe una clasificación para la materia. Cuando clasificamos, agrupamos objetos que tienen características iguales, como cuando vamos a lavar la ropa y la dividimos por colores.
La materia se puede clasificar por su composición. Para eso se hace uso de las cualidades de la materia. Estas cualidades pueden ser cuantitativas o cualitativas. Las cuantitativas se refieren a cantidad y las cualitativas a las cualidades de la materia.
La clasificación de la materia se presenta en el presente diagrama: 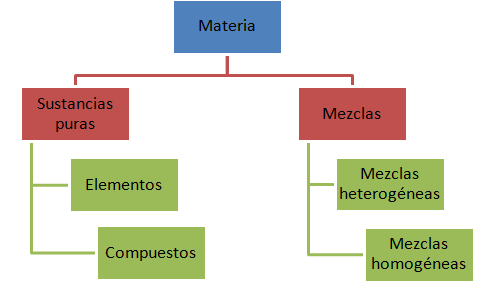
Sustancias puras
Las sustancias puras son materia que está compuesta de propiedades y composición fija. Las sustancias puras se clasifican en elementos y compuestos.
Un elemento es una sustancia pura que no se puede dividir en sustancias más simples. Todos los elementos se agrupan en la Tabla Periódica que estudiaremos más adelante. Por su parte, los compuestos son combinaciones químicas de dos o más elementos que están unidos en una proporción fija.
Mezclas
Las mezclas son combinaciones de dos o más sustancias, en la cual la identidad y las propiedades de cada sustancia no cambian. Las mezclas tampoco son todas iguales. Éstas se clasifican en homogéneas y heterogéneas. Una mezcla homogénea se puede identificar fácilmente porque se crean capas, como cuando mezclamos agua y aceite. Las mezclas homogéneas se ven uniformes, como el jugo de china.
Las mezclas se pueden separar utilizando las propiedades de las sustancias que las componen. Por ejemplo, ¿cómo puedes separar una mezcla de agua con sal?
Para separar una mezcla de agua con sal, se hace uso de una de las propiedades físicas del agua, que es que puede cambiar de estado. Si tomas una muestra de agua con sal y la colocas en una olla a fuego mediano, en algún momento, el agua se evaporará. ¿Qué crees que quedará en el fondo de la olla? La sal.
Propiedades de la materia
Como se explicó anteriormente, las propiedades se refieren a las cualidades que tiene la materia. Estas propiedades pueden ser físicas o químicas. En las próximas secciones encontrará información sobre estos dos tipos de propiedades de la materia.
TRABAJO 1 - Identifica mezclas homogéneas y heterogéneas. (12 pts.)
Utiliza las siguientes láminas e identifica el tipo de mezcla que muestra 
· Contesta:
1. Define materia, propiedades físicas y propiedades químicas. (6 pts.)
2. ¿Por qué es importante estudiar la materia? (4 pts.)
3. Menciona dos ejemplos de sustancias puras. (4 pts.)
4. Menciona dos ejemplos de mezclas. (4 pts.)
· TRABAJO 2 - Carta a un amigo.
En tu libreta, escribe una carta a un amigo sobre lo que has aprendido de la materia. Explícale cómo puede clasificar la materia. A continuación, un ejemplo del formato de una carta. 
© Derechos Reservados
Escuela Virtual de Educación Acelerada Proyecto Salón Hogar Inc.
|