|
|
|
El creador de la vacuna
contra la rabia, el químico y biólogo francés Luis Pasteur, ha sido uno
de los científicos más destacados de la humanidad. |
| |
 Química
es la ciencia que estudia la estructura, propiedades y transformaciones
de la materia a partir de su composición atómica, formando diferentes
substancias. Química
es la ciencia que estudia la estructura, propiedades y transformaciones
de la materia a partir de su composición atómica, formando diferentes
substancias.Los orígenes de la teoría atómica se
remontan a la Grecia antigua, a la escuela filosófica de los atomistas.
La base empírica para tratar a la teoría atómica de acuerdo con el
método científico se debe a un conjunto de trabajos aportados por
Lavoiser, Proust, Richter, Dalton, Gay-Lussac y Avogadro, entre otros,
hacia principios del siglo XIX. |
|
|
El átomo es
la menor fracción de materia de interés directo para la química, está
constituído por diferentes partículas que poseen diferentes tipos de cargas,
los electrones con carga negativa, los protones con carga positiva y los
neutrones que como su nombre lo indica son neutros (sin carga); todos ellos
aportan masa para contribuir al peso del átomo. El estudio explícito de las
partículas subatómicas es parte del dominio de la física, la química sólo
está interesada en estas partículas en tanto en cuanto éstas definan el
comportamiento de átomos y moléculas.
Conceptos fundamentales
Partículas
 Los átomos son las partes más
pequeñas de un elemento (como el carbono, el hierro o el oxígeno). Todos los
átomos de un mismo elemento son (casi) iguales. Las moléculas son las partes
más pequeñas de una sustancia (como el azúcar), y se componen de átomos. Si
tienen carga eléctrica, tanto átomos como moléculas se llaman iones:
cationes si son positivos, aniones si
son negativos. Los átomos son las partes más
pequeñas de un elemento (como el carbono, el hierro o el oxígeno). Todos los
átomos de un mismo elemento son (casi) iguales. Las moléculas son las partes
más pequeñas de una sustancia (como el azúcar), y se componen de átomos. Si
tienen carga eléctrica, tanto átomos como moléculas se llaman iones:
cationes si son positivos, aniones si
son negativos.
Como los átomos, las moléculas y los iones
son muy pequeños, normalmente se trabaja con enormes cantidades de ellos. El
mol usa como
contador de unidades, como la docena (12) o el millar (1000), y equivale a
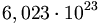 .
Se dice que 12 gramos de carbono, o un gramo de hidrógeno, o 56 gramos de
hierro, contienen aproximadamente un mol de átomos. .
Se dice que 12 gramos de carbono, o un gramo de hidrógeno, o 56 gramos de
hierro, contienen aproximadamente un mol de átomos.
Dentro de los átomos, podemos encontrar un
núcleo atómico y uno o más electrones. Los electrones son muy importantes
para las propiedades y las reacciones químicas
De los átomos a las moléculas
Los enlaces son las uniones entre átomos para
formar moléculas. Siempre que existe una molécula es porque ésta es más
estable que los átomos que la forman por separado. A la diferencia de
energía entre estos dos estados se le denomina energía de enlace.
Generalmente, los átomos se combinan en
proporciones fijas para dar moléculas. Por ejemplo, dos átomos de hidrógeno
se combinan con uno de oxígeno para dar una molécula de agua. Esta
proporción fija se conoce como estequiometría.
Orbitales
Para una descripción y comprensión detalladas
de las reacciones químicas y de las propiedades físicas de las diferentes
sustancias, es muy útil su descripción a través de orbitales, con ayuda de
la mecánica cuántica.
Un orbital atómico es una función matemática
que describe la disposición de uno o dos electrones en un átomo. Un orbital
molecular es análogo, pero para moléculas.
De los orbitales a las sustancias
Los orbitales son funciones matemáticas para
describir procesos físicos: un orbital solo existe en el sentido matemático,
como pueden existir una suma, una parábola o una raíz cuadrada. Los átomos y
las moléculas son también idealizaciones y simplificaciones: un átomo sólo
existe en vacío, una molécula sólo existe en vacío, y, en sentido estricto,
una molécula sólo se descompone en átomos si se rompen todos sus enlaces.
En el "mundo real" sólo existen los
materiales y las sustancias. Si se confunden los objetos reales con los
modelos teóricos que se usan para describirlos, es fácil caer en falacias
lógicas.
Disoluciones
En agua, y en otros disolventes (como la
acetona o el alcohol), es posible disolver sustancias, de forma que quedan
disgregadas en las moléculas o iones que las componen (las disoluciones son
transparentes). Cuando se supera cierto límite, llamado solubilidad, la
sustancia ya no se disuelve, y queda, bien como precipitado en el fondo del
recipiente, bien como suspensión, flotando en pequeñas partículas (las
suspensiones son opacas o traslúcidas).
Se denomina concentración a la medida de la
cantidad de soluto por unidad de cantidad de disolvente.
Medida de la concentración
La concentración de una disolución se puede
medir de diferentes formas, en función de la unidad empledad para determinar
las cantidades de soluto y disolvente. Las más usuales son:
Acidez
El pH es una escala logarítmica para
describir la acidez de una disolución acuosa. Los ácidos, como el zumo de
limón y el vinagre, tienen un pH bajo (inferior a 7). Las bases, como la
sosa o el bicarbonato de sodio, tienen un pH alto (superior a 7).
Formulación y nomenclatura
La IUPAC, un organismo internacional,
mantiene unas reglas para la formulación y nomenclatura química. De esta
forma, es posible referirse a los compuestos químicos de forma sistemática y
sin equívocos.
Mediante el uso de fórmulas químicas es
posible también expresar de forma sistemática las reacciones químicas, en
forma de ecuación química.
Campos de la química
-
Bioquímica - la química de los seres vivos
y los procesos de la vida
-
Química analítica - determinación
cualitativa y cuantitativa de la composición de las muestras
-
Química física - determinación de las
leyes y las constantes fundamentales que rigen los procesos
-
Química inorgánica - síntesis y estudio de
los compuestos que no se basan en cadenas de carbono
-
Química orgánica - síntesis y estudio de
los compuestos basados en cadenas de carbono
-
Química técnica - la química aplicada a
procesos industriales
-
y otras disciplinas de la química
|

|
|
El aporte de la
tecnología al desarrollo, no solo de la química, sino que de la
ciencia en general, ha sido fundamental. |
|
|
El
método científico |
|
Básicamente, las etapas que se necesitan para establecer una
ley científica son tres: observar hechos comunes o
extraordinarios; suponer una cosa posible, es decir,
establecer una hipótesis que, si resulta verdadera, explique
esos hechos, y deducir de esta hipótesis consecuencias que
puedan ser puestas a prueba por la observación. Si las
consecuencias son comprobadas, se acepta temporalmente la
hipótesis como verdadera, aunque después se modifique por
nuevos descubrimientos.
Como bien lo ejemplifica el filósofo inglés Bertrand Russell
“... en esencia, el primer hombre que dijo: ‘el fuego quema’,
estaba empleando el método científico; sobre todo si había
decidido quemarse varias veces”. |
|
|
| |
Naturaleza de la química
La química es una disciplina
cuyo objeto de estudio es la descripción de las propiedades
de las sustancias y los intercambios de materia que se
establecen entre ellas, denominados reacciones químicas.
Dentro de las ciencias, la química es una de las más
entretenidas, pues con ella se puede aprender y conocer una
serie de nuevos conceptos, los cuales se pueden poner a
prueba por medio de la experimentación.
Sin embargo, la química no
solo se encarga de estudiar los elementos químicos, su
estructura y organización en la tabla periódica y las
reacciones químicas en las cuales interactúan. También es
una ciencia integral y disciplinaria, pues por medio de su
estudio podemos comprender otras ciencias, como la
bioquímica, la biología, la fisiología y la físico-química.

La química está presente en
nuestra vida diaria. Por ejemplo: al alimentarnos
diariamente, nos nutrimos, ya que la comida nos proporciona
energía, la que se produce debido a diferentes
reacciones químicas ocurridas en nuestras células. Esta
energía la usamos para caminar, correr y estudiar, entre
otras actividades. Ahora mismo puedes leer sin problemas
gracias a que tu cuerpo está liberando energía proveniente
de las reacciones químicas, que tú mismo, sin darte cuenta,
estás generando en tu organismo. Asimismo, los mismos
alimentos que consumimos (leche, frutas y carnes, por
ejemplo) son producto de reacciones químicas complejas.
|
|
|
|
 Qué estudia la
química Qué estudia la
química
En este número comenzaremos a
descubrir los secretos de la química y veremos cómo está presente en
todas nuestras actividades y, prácticamente, en todo lo que nos
rodea. Sin embargo, antes de abordar el estudio de la química es
importante conocer qué es ciencia.
 La
palabra ciencia proviene del latín scientia, que significa saber.
Pero no todo el conocimiento cabe dentro de la categoría de ciencia;
para que una disciplina pueda ser catalogada como tal, debe reunir
ciertas características, entre las que se encuentran el ser
sistemática, metódica, especializada y abierta
y que produzca investigación científica. La
palabra ciencia proviene del latín scientia, que significa saber.
Pero no todo el conocimiento cabe dentro de la categoría de ciencia;
para que una disciplina pueda ser catalogada como tal, debe reunir
ciertas características, entre las que se encuentran el ser
sistemática, metódica, especializada y abierta
y que produzca investigación científica.
Las diferentes ciencias conocidas se
agrupan en: ciencias exactas (ver glosario), es decir,
la matemática, física y química; ciencias biológicas (ver
glosario), como la zoología, botánica, genética y ecología;
ciencias geológicas y geográficas, ciencias médicas y ciencias
sociales (ver glosario), como la economía, sociología y
demografía.
Para llegar a nuevos conocimientos,
los científicos e investigadores de cada una de las diferentes
ciencias tuvieron como punto de partida la observación; los
grandes inventos y las sorprendentes teorías que hasta el día de hoy
sirven de base a la creación de nueva tecnología, han tenido su
origen en experiencias o fenómenos que los hombres con mentalidad
científica han enfrentado, incluso en situaciones muy cotidianas, y
que han sabido reconocer como hechos significativos.
 Cómo hacer ciencia:
el método científico Cómo hacer ciencia:
el método científico
Quizás pienses que la ciencia es
propiedad de los grandes científicos y que estos, antes de realizar
sus descubrimientos, siguieron una serie de pasos que les
permitieron demostrar, mediante experimentos, sus hallazgos en
determinado campo de estudio.
Sin embargo, en la vida diaria,
nosotros también desarrollamos, en cierto nivel, conocimientos. Por
ejemplo: si nunca has visto una determinada fruta en tu vida, cuando
llega a tus manos, por lo general lo primero que haces es observar
su forma, preguntándote cuál será su sabor o si es venenosa. Luego
la tocas, la hueles y si su aroma es agradable, la comes y aprecias
su sabor. En este caso, descubriste algo nuevo sin necesidad de ser
un gran científico.
Sin embargo, aplicaste, quizás sin
saberlo, algunos pasos básicos de lo que se conoce como método
científico, el cual integra una serie de etapas, como la
observación, el problema, la hipótesis y la
experimentación, situaciones similares al ejemplo de la fruta.
En las siguientes páginas podrás
reconocer los pasos de este método, a través de los experimentos que
iremos desarrollando.
Entre las ciencias existen
diferencias; por ejemplo, entre la química y las ciencias sociales.
En ambas se usa el método científico, pero en la química hay mayor
precisión en la predicción de efectos y posterior ratificación de
las etapas del método científico. Por lo tanto, la química es una
ciencia exacta, no así las ciencias sociales, porque no siempre es
técnicamente posible el desarrollo de las experiencias que plantea,
por lo que no puede comprobar sus hipótesis.
En la naturaleza estas reacciones se
efectúan a diario en los organismos. La fotosíntesis es un
ejemplo. A través de ella, las plantas sintetizan azúcares que son
almacenados en órganos especializados, como los frutos que luego nos
servimos. Y así podemos seguir enumerando muchas otras reacciones en
las cuales la química se hace presente en nuestras vidas.
Los inicios de la química
Empédocles de Agrigento (430
a.C) afirmó que la Tierra estaba formada por cuatro elementos:
tierra, aire, agua y fuego.
Aristóteles (330 a.C) supuso,
además, que el cielo constituía un quinto elemento, llamado éter.
Los griegos creían que las sustancias de la Tierra estaban formadas
por distintas combinaciones de estos elementos. Asimismo, se
planteaban la cuestión de si la materia podía ser dividida
indefinidamente, o si se llegaría a un punto en el que las
partículas fuesen indivisibles.
Fue el filósofo Demócrito de
Abdera quien concluyó que las partículas indivisibles eran los
átomos, palabra que significa ‘no divisible’, y sugirió que algunas
sustancias estaban compuestas por diversos átomos o combinaciones de
estos. También pensaba que una sustancia podía convertirse en otra
al ordenar sus átomos de diferente manera.
Los alquimistas de la Edad
Media fueron los impulsores de teorías y especulaciones químicas,
pero que no se basaban en la experimentación, sino en suposiciones y
creencias acerca de un fenómeno determinado. La mayoría de ellos
trabajaban estimulados por la posibilidad de transformar los metales
ordinarios en oro, creyendo que estos eran compuestos formados por
mercurio y azufre en diferentes proporciones y que si se lograba
cambiar la cantidad de estos elementos dentro de las sustancias, se
obtendría el preciado metal. Su labor explicó las reacciones
químicas despertando el interés por estudiar lo que hoy llamamos
reactivos químicos.
Solo unos pocos alquimistas aplicaron
sus conocimientos a otras áreas, como en el caso de Philippus
Theophrastus Bombasto von Hohenheim, más conocido como Paracelso,
el cual derivó a la medicina lo aprendido con la alquimia, logrando
importantes éxitos. |
|
|
|





